Optogénétique : lumière sur notre cerveau !
Alors qu’il ne représente que 2% de la masse du corps humain, le cerveau consomme entre 20 et 25% de l’énergie totale d’un être humain. Véritable ordinateur de bord des êtres vivants, le cerveau fait l’objet depuis la Grèce Antique de fantasmes et de recherches empiriques.
Les premières études anatomiques du cerveau lors de la Renaissance mettent à jour un organe complexe dont les ramifications nerveuses s’étendent dans l’ensemble du corps et permettent l’activation de chaque organe du corps[1]. Toutefois, ces avancées ne permettent pas encore de comprendre comment cette masse visqueuse et grisâtre qu’est le cerveau transmet ses informations au système nerveux. Il faudra attendre les travaux de l’Espagnol Santiago Ramón y Cajal (Prix Nobel de Médecine en 1906) et sa Théorie du neurone[2] pour admettre que le cerveau n’était pas un maillage de cellules non isolées mais bel et bien un ensemble complexe fait de cellules neuronales[3].

Les années 1950 fortes des progrès de la recherche biologique voient naître un nouveau champ transdisciplinaire : les neurosciences qui étudient le système nerveux, à la fois d’un point de vue de sa structure mais aussi de son fonctionnement depuis l’échelle moléculaire jusqu’au niveau des organes. Le champ d’investigation ne cesse de grandir à mesure que les connaissances du fonctionnement du cerveau évoluent mais aujourd’hui encore, ce dernier reste en partie mystérieux. C’est la raison pour laquelle, depuis une dizaine d’année, un nouveau domaine de recherche à la charnière de l’optique et de la génétique propose des outils qui pourraient permettre, à terme, de dessiner une cartographie très précise des réseaux de neurones : l’optogénétique permet de stimuler spécifiquement certains neurones sans toucher les neurones voisins. Les perspectives en matière de recherche médicale sont prometteuses et aujourd’hui le focus est notamment mis sur les maladies neurodégénératives. Pour autant, comme nous allons le voir dans cette nouvelle note de veille, cette biotechnologie n’a pas encore réellement franchi les portes des laboratoires de recherche même si l’engouement est évident.
Comment fonctionne un cerveau ?
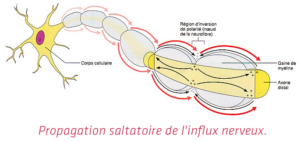
Pour comprendre en quoi l’optogénétique est un domaine qui soulève beaucoup d’enthousiasme, il faut au préalable comprendre le fonctionnement du cerveau. Le cerveau est composé de plus de 100 milliards de cellules nerveuses, « les neurones », qui constituent un réseau câblé très précis. Les neurones communiquent entre eux par signaux électriques, appelés influx nerveux (ou potentiels d’action). Quand un neurone est activé, il envoie un « signal électrique », via un axone[4], vers les autres neurones auxquels il est connecté : on dit que le neurone décharge[5]. Cette décharge est en fait un transfert d’ions (positifs ou négatifs[6]) de part et d’autre de la membrane qui délimite les neurones, la charge étant légèrement inférieure à l’intérieur. On dit qu’elle est polarisée. Toutefois les neurones sont capables de modifier cette polarisation, grâce à une protéine : le canal sodium. Cette modification de polarisation correspond au potentiel d’action. Ce dernier se propage de neurones en neurones via les axones qui vont s’ouvrir à mesure que leur voisinage se dépolarise. Et c’est grâce à cette réaction en chaîne qu’un signal peut se propager le long de l’axone d’un neurone jusqu’aux neurones auxquels il est connecté[7].
La connaissance du fonctionnement neuronal du cerveau a permis de nombreuses avancées notamment celle du contrôle de l’activation des neurones. Deux grandes méthodes existent :
- par l’utilisation d’une électrode enfoncée dans le cerveau qui délivre des impulsions électriques : on parle de simulation cérébrale profonde. Cette méthode a le défaut d’exciter une zone entière, sans cibler un type de neurones particulier.
- par l’injection de molécules qui vont venir se fixer sur les neurones visés. Malheureusement, cette méthode, si elle est précise, ne permet pas une activation instantanée du neurone.
La question est alors de savoir comment réussir à activer/désactiver certains neurones instantanément tout en préservant leurs voisins de toute modification ?
L’optogénétique, l’interrupteur de neurones
L’optogénétique semble être, en partie du moins, une réponse à cette interrogation. Mixant le génie génétique à l’optique, l’optogénétique est une méthode scientifique permettant de rendre sensibles à la lumière des neurones sans affecter les neurones à proximité. Développée par le neurologiste et psychiatre de Stanford, Karl Deisseroth, l’optogénétique a été élue méthode de l’année d’après Nature Methods en 2010.
L’activation des neurones par la lumière est rendue possible grâce à l’injection (via un virus) d’une protéine[8], la channelrhodopsine 2 (ChR2), qui est un canal ionique, permettant le passage d’ions à travers les membranes, mais uniquement en présence de lumière[9]. Ainsi, en éclairant la protéine avec de la lumière, le chercheur est capable de stimuler le neurone qui y est attaché sans que le sujet (le plus souvent une souris ou une mouche) ne contrôle le mouvement.
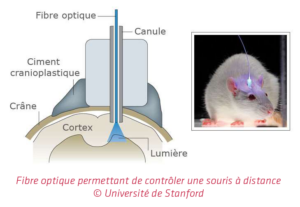
Il est donc possible, grâce à l’optogénétique, de faire marcher une souris par impulsion lumineuse. La recherche a permis depuis d’identifier d’autres protéines (les opsines réagissant à l’énergie lumineuse), de les combiner afin que certaines réagissent à la lumière et d’autres interagissent avec les neurones. L’idée est donc bien d’utiliser la combinaison lumière + génie génétique pour exciter ou inhiber certains neurones afin de comprendre l’impact sur le comportement de l’animal.
Quelles applications pour l’optogénétique ?
Karl Deisseroth est parvenu, en 2012, à corriger les symptômes de la dépression en activant une zone de neurones dopaminergiques dans le cerveau de souris. Cette expérience a confirmé l’hypothèse préalable que cette zone était liée à la motivation et à la récompense. Elle a été suivie par d’autres recherches qui ont mené à l’activation de neurones liés aux souvenirs positifs pour lutter contre la dépression. D’autres expériences ont été menées afin d’activer/désactiver les neurones responsables de la faim (ou de la satiété) et de la soif chez la souris. Une étude publiée dans Nature Photonics en 2013 montre même le pouvoir de l’optogénétique sur la tolérance au glucose chez la souris diabétique ouvrant des perspectives importantes dans le traitement de cette maladie.
La technique pourrait également être utilisée pour réguler le rythme cardiaque : de nombreuses recherches vont dans ce sens. Des chercheurs ont mis au point un système d’autodestruction des cellules pilotable par la lumière : l’objectif est de comprendre le mécanisme de la neurodégénérance. Ainsi, des essais ont été entrepris pour utiliser la lumière dans le cadre de la DMLA ou de la cécité. Mais elle pourrait également offrir des motifs d’espoir aux personnes victimes de la maladie d’Alzheimer en rétablissant le fonctionnement des ondes cérébrales ou encore en proie à la maladie de Parkinson pour laquelle des essais sur des souris parkinsoniennes ont été entrepris.
Les exemples de recherches portant sur les animaux de laboratoires sont nombreux mais la question qui est aujourd’hui la plus brûlante est de savoir si la recherche peut dépasser le stade de l’essai sur animal pour être convertie en traitement pour les humains. Il s’agit de savoir jusqu’où les recherches concernant le cerveau humain pourront éthiquement aller et, au-delà, il s’agira de se questionner sur les problèmes éthiques soulevés par l’utilisation d’implants en vue d’améliorer l’être humain.
[1] Le premier grand pas vers la médecine moderne provient des recherches de Luigi Galvani, qui découvre qu’une décharge d’électricité statique appliquée sur le nerf d’une grenouille morte provoque la contraction de sa jambe.
[2] Qui sera complétée par Heinrich Wilhelm Waldeyer. C’est ce dernier qui proposa le mot « neurone » pour désigner les cellules nerveuses.
[3] Mises en évidence grâce à la méthode de coloration argentique mise au point par Camillo Golgi quelques années plus tôt.
[4] L’axone, ou fibre nerveuse, est le prolongement du neurone qui conduit le signal électrique du corps cellulaire vers les zones synaptiques.
[5] C’est la myéline, la gaine protectrice présente le long des axones des neurones, qui permet la propagation de l’influx nerveux.
[6] Les ions Sodium (Na+) sont positifs quand l’ion chlorure est chargé négativement (Cl-) par exemple.
[7] Pour plus de détails sur l’influx nerveux et sa propagation voir ce lien.
[8] En biologie, la fonction d’une protéine est liée à un changement de conformation : elle devient active ou non en changeant de forme. Ce changement lui permet d’interagir avec ses partenaires afin de déclencher une action de la cellule.
[9] Un des intérêts de cette méthode est sa réversibilité. Une fois l’expérience menée et la lumière coupée, la protéine reprend sa forme initiale et ne communique plus avec les neurones. L’animal reprend le contrôle de ses actes.
Rédacteur : Alexandre BERTIN
Vous pouvez nous suggérer des thèmes que vous souhaiteriez voir traités dans une prochaine Note (ou Dossier) de Veille
veille@unitec.fr | communication@digital-aquitaine.com
Télécharger la note de veille au format .pdf

Voir toutes les publications de veille d’Unitec






