Les enjeux de la production d’ARNm
Toutes ces perspectives de développement médical (auxquelles on peut ajouter celles liées à l’agriculture du futur ou la santé animale) nécessitent une utilisation massive d’ARNm. Lors de la campagne de vaccination contre le virus de la Covid-19, il a fallu très rapidement produire des brins d’ARNm pour répondre aux enjeux cruciaux d’une telle pandémie. Dès lors, la production de l’ARNm devient un enjeu majeur et répond à des étapes bien précises.
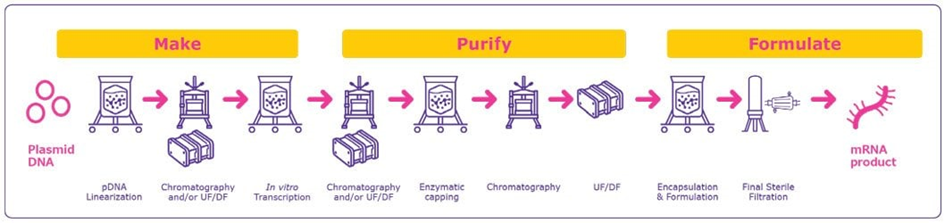
1 – Conception et synthèse in vitro : La première étape consiste à synthétiser l’ARNm in vitro en utilisant une matrice d’ADN linéarisé. Ce processus se fait généralement par transcription in vitro, une méthode dans laquelle des enzymes comme l’ARN polymérase sont utilisées pour transcrire de l’ADN en ARNm. Cette étape est cruciale pour s’assurer que l’ARNm produit est fonctionnel et exempt de contaminants.
2 – Modification chimique : Pour stabiliser l’ARNm et éviter une dégradation rapide dans l’organisme, il peut être modifié chimiquement. Les modifications incluent généralement l’ajout d’une coiffe en 5′ et d’une queue poly-A, qui protègent l’ARNm de la dégradation enzymatique et facilitent la traduction en protéines.
3 – Purification : L’ARNm doit être purifié pour éliminer toute trace d’ADN, d’enzymes, ou d’autres sous-produits issus du processus de transcription. La purification se fait via des techniques telles que la chromatographie ou l’ultrafiltration, assurant que l’ARNm final soit de haute pureté.
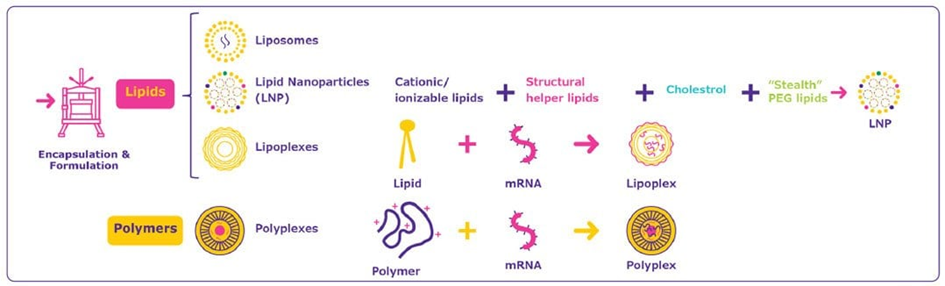
4 – Encapsulation dans des nanoparticules lipidiques (LNP) : Comme l’ARNm est instable et pourrait se dégrader rapidement dans le corps, il est encapsulé dans des nanoparticules lipidiques (LNP) qui le protègent et facilitent son passage à travers la membrane des cellules. Ce processus est crucial pour le succès de la thérapie, car il permet à l’ARNm d’atteindre les cellules cibles.
5 – Contrôle qualité : Avant que l’ARNm ne soit prêt pour la distribution et l’utilisation clinique, il doit passer par un ensemble rigoureux de contrôles de qualité. Cela inclut la vérification de sa pureté, de son intégrité et de sa capacité à être traduit en la protéine cible. Des tests sont également effectués pour garantir qu’aucun contaminant biologique ou chimique n’est présent.
Mais produire de l’ARNm n’est pas sans coût. Ce coût dépend de plusieurs facteurs, notamment la complexité des processus de fabrication et la disponibilité des matières premières. Actuellement, la production d’ARNm, bien qu’elle soit plus rapide que celle des vaccins traditionnels, reste très coûteuse en raison de certains composants clés et de la technologie de fabrication.

Le marché de la production d’ARNm est un marché porteur tiré par plusieurs facteurs de croissance : la prévalence croissante des maladies infectieuses, une attention accrue aux soins préventifs, l’augmentation des investissements en R&D pour la mise au point de vaccins basés sur l’ARNm et les politiques nationales de promotion de la vaccination à travers le monde et dans les pays du Sud plus particulièrement. Le marché mondial des vaccins anticancéreux à ARNm devrait, par exemple, connaître une croissance significative, avec des estimations allant de 230 à 300 milliards de dollars d’ici 2035. Selon Cyvita, les vaccins Pfizer/BioNTech et Moderna contiennent respectivement 30 μg et 100 μg d’ARNm non répliquant. Pour une campagne de production d’un milliard de doses, il serait nécessaire de produire entre 30 et 100 kg d’ARNm hautement purifié avec les coûts de production qui vont avec. Aujourd’hui, les ARNm sont produits par transcription d’ADN in vitro, coûteuse et difficile pour soutenir des volumes croissants, car elle nécessite de nombreux réactifs (ADN, enzymes, nucléosides modifiés…), dépend de nombreux brevets et présente de multiples étapes. Si les coûts ne cessent de baisser, en 2022, produire 1 kilogramme d’ARN coûtait entre 25M de dollars et 50M de dollars.
Deux méthodes de production de l’ARNm sont aujourd’hui concurrentes, présentant chacune, avantages et inconvénients. D’un côté, certaines entreprises (Moderna Therapeutics, BioNTech, CureVac, Arcturus Thérapeuthics ou eTheRNA) proposent une méthode de production basée sur la synthèse enzymatique in vitro d’ARN polymérases. Cette méthode permet de produire de grandes quantités d’ARNm de haute qualité, avec des modifications spécifiques si nécessaire. Elle offre un contrôle précis sur la séquence et la structure de l’ARNm produit, ce qui est crucial pour les applications thérapeutiques. La synthèse enzymatique est actuellement la méthode la plus utilisée pour la production d’ARNm à grande échelle, notamment pour les vaccins et les thérapies basées sur l’ARNm. Cependant, elle présente certains défis, notamment en termes de coût et de mise à l’échelle, que des entreprises comme bYoRNA (dont nous présentons la solution ci-dessous) cherchent à surmonter avec des approches alternatives comme la production en cellules eucaryotes. Outre bYoRNA, d’autres entreprises proposent cette méthode comme Vernal Biosciences ou Sensible Therapeutics (qui propose des thérapies antisens, basées sur l’inactivation des gènes réputés anormaux les empêchant de fonctionner. Cette méthode reste pour l’heure très expérimentale)
Une innovation – Une Start-up : bYoRNA
bYoRNA est une start-up biotechnologique spécialisée dans la production d’ARN messager (ARNm) thérapeutique. Accompagnée par Unitec, sa technologie innovante se concentre sur la production, l’isolation et l’extraction d’ARNm à l’aide de cellules eucaryotes.
Que sont les cellules eucaryotes ?
Les cellules eucaryotes ont un noyau qui contient l’ADN et où se forme un ARNm mature, proche de l’ARNm humain, ce qui les distingue des cellules procaryotes (comme les bactéries) qui sont pour leur part dépourvues de noyau et dont l’ARNm est immunogénique pour les êtres humains.
Comment bYoRNA fabrique-t-elle l’ARNm ?
bYoRNA utilise une technologie brevetée pour produire de l’ARNm dans des levures, organismes eucaryotes. Cette technologie permet de surmonter plusieurs obstacles rencontrés dans la production traditionnelle d’ARNm in vitro, a le potentiel des ARNm à une fraction du coût de production actuel, et d’une longueur bien plus grande, ce qui permettra de fabriquer notamment des ARNm autoamplifiants (saRNA), de réduire l’immunogénicité (effets secondaires), et d’améliorer l’efficacité des ARNm thérapeutiques.
bYoRNA utilise les levures comme des « usines cellulaires » pour produire de l’ARNm, in vivo. Ces levures sont modifiées génétiquement pour inclure des rétrosomes, sorte de capsides protéiques qui protègent l’ARNm d’intérêt à l’intérieur de la cellule. La technologie repose sur l’encapsulation de l’ARNm thérapeutique dans ces rétrosomes, ce qui permet de le protéger contre la dégradation enzymatique par des RNAses présentes dans le cytoplasme. Cela améliore ainsi la stabilité de l’ARNm et sa pureté, condition nécessaire pour pouvoir en produire des quantités industrielles grâce à un procédé basé sur la biotechnologie classique.
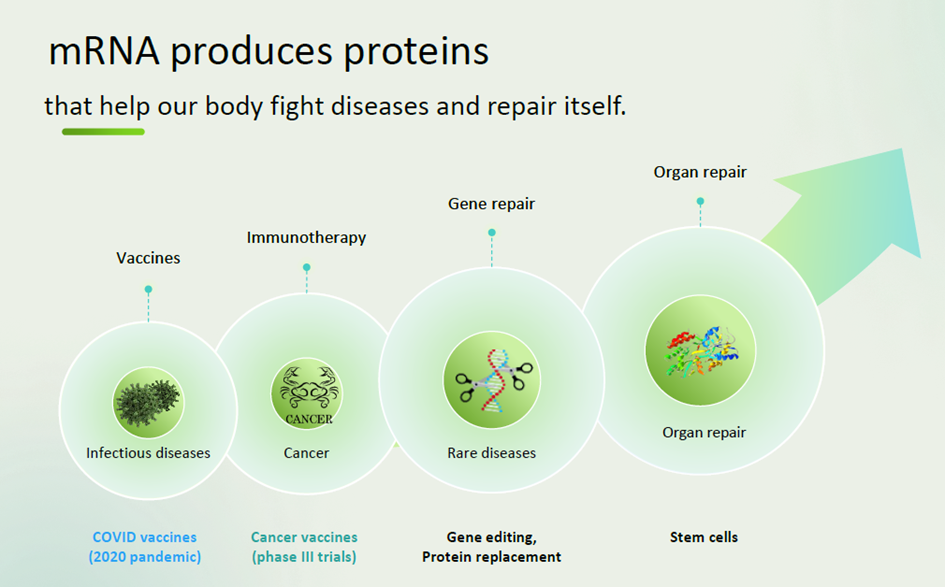
La vision de bYoRNA sur le potentiel de l’ARNm (Source : www.byorna.bio)
La proposition de valeur de bYoRNA
Une efficacité accrue : la technologie brevetée de bYoRNA permettra la production d’ARNm plus longs et plus complexes à un coût compétitif, ce qui est essentiel pour le développement de nouvelles thérapies au-delà des vaccins.
Une sécurité améliorée : la production dans les levures est sûre et permettra, grâce à la production d’ARNm autoamplifiants (saRNA) de réduire le risque d’immunogénicité.
Une production locale et durable : bYoRNA permet une production locale d’ARNm naturel en utilisant les capacités de production existantes, ce qui favorise la souveraineté et réduit l’impact environnemental.
Une technologie accessible : la production en levure réduit les coûts de production grâce à l’utilisation de matières premières facilement accessibles et moins onéreuses et à un processus de production plus efficace.
Un accès au marché et la possibilité de co-développement: bYoRNA adopte un modèle commercial de co-développement avec des entreprises de biotechnologie, des institutions académiques et de grandes entreprises pharmaceutiques, leur permettant d’accéder à sa technologie innovante et de collaborer sur le développement de nouvelles thérapies à ARNm.
Marchés cibles de la technologie bYoRNA
La technologie brevetée bYoRNA a le potentiel de révolutionner la production d’ARNm, en la rendant plus sûre, plus efficace et plus abordable.
Voici quelques marchés cibles :
- Vaccins contre les maladies infectieuses : l’ARNm est déjà utilisé dans les vaccins contre la Covid-19, et la technologie bYoRNA pourrait permettre de développer des vaccins plus efficaces contre d’autres maladies infectieuses.
- Immunothérapie : L’ARNm peut être utilisé pour stimuler le système immunitaire à attaquer les cellules cancéreuses. La technologie bYoRNA pourrait permettre de développer des immunothérapies plus efficaces et moins coûteuses.
- Thérapie génique : L’ARNm peut être utilisé pour remplacer ou réparer des gènes défectueux. La technologie bYoRNA pourrait permettre de développer des thérapies géniques plus sûres et plus efficaces.
- Remplacement de protéines : L’ARNm peut être utilisé pour produire des protéines thérapeutiques. La technologie bYoRNA pourrait permettre de produire des protéines thérapeutiques à grande échelle et à faible coût.
Et les clients que bYoRNA vise :
· Les entreprises de biotechnologie
· Les entreprises pharmaceutiques
· Les institutions universitaires et de recherche
bYoRNA cible un marché de l’ARNm qui double tous les trois ans et prévoit de créer une cinquantaine d’emplois dans la région Nouvelle Aquitaine d’ici 5 ans.
3 questions à Pascal Viguié et Thierry Ziegler, respectivement CEO et CTO de bYoRNA
Comment et pourquoi bYoRNA fabrique-t-elle l’ARNm ?
bYoRNA utilise une technologie brevetée pour produire de l’ARNm in vivo dans des levures eucaryotes (un noyau au sein duquel l’ARNm est transformé et maturé), et qui permet de surmonter plusieurs obstacles rencontrés dans la production traditionnelle d’ARNm in vitro. Plusieurs bénéfices : une efficacité accrue, une sécurité améliorée, une production locale et durable, et une technologie accessible financièrement.
Quels sont vos marchés cibles ?
Celui des vaccins, bien entendu, car la technologie bYoRNA permettrait de développer des vaccins plus efficaces contre de nombreuses maladies infectieuses. L’immunothérapie avec des solutions plus efficaces et surtout moins coûteuses, mais aussi la thérapie génique. Enfin, le remplacement de protéines : notre technologie faciliterait la production de protéines thérapeutiques à grande échelle et à faible coût. Ces marchés sont détenus par des entreprises de biotechnologie, des groupes pharmaceutiques qui cherchent à externaliser la production d’ARNm, et les institutions universitaires et de recherche. Nous prévoyons un chiffre d’affaires de 30 millions d’€ d’ici 2030, sur un marché de l’ARNm qui double en moyenne tous les trois ans.
Pour quelles raisons vous développez-vous en Gironde ?
bYoRNA se développe en Gironde grâce à un accompagnement entrepreneurial remarquable comme celui que procurent l’incubateur UNITEC, l’ADI et INVEST IN BORDEAUX, la présence d’établissements de formation réputés comme l’ENSTBB qui nous a hébergé la première année, et un soutien institutionnel fort de la région Nouvelle-Aquitaine (nous avons bénéficié d’une subvention pour l’achat d’équipement pour nos nouveaux laboratoires). La qualité de vie est évidemment un plus, et le fait que Thierry Ziegler et Pascal Viguié, les deux fondateurs, aient déjà vécu en région bordelaise rendaient ce choix évident.
Lire la version courte de la note sur Les échos Judiciaires – Girondins






