La découverte de l’ARN messager (ARNm) a été une étape clé dans la compréhension des mécanismes de la biologie moléculaire. Dès les années 1950, les scientifiques savaient que l’ADN contenait l’information génétique et que les protéines étaient les molécules effectrices, mais le mécanisme reliant l’ADN aux protéines restait un mystère.
Le concept d’un intermédiaire entre l’ADN et les protéines a émergé progressivement, avec l’idée que cette molécule pourrait servir de « messager » transportant les instructions génétiques depuis le noyau jusqu’au cytoplasme où les protéines sont synthétisées. Cette hypothèse a été renforcée par les découvertes de plusieurs scientifiques sur la nature de la transcription et de la traduction.
Plusieurs chercheurs ont joué un rôle crucial dans la découverte de l’ARNm.
En 1961, François Jacob et Jacques Monod deux biologistes français ont été parmi les premiers à proposer l’existence d’une molécule d’ARN messager. Travaillant sur la régulation des gènes chez Escherichia coli, ils ont proposé un modèle dans lequel l’ARNm sert d’intermédiaire entre l’ADN et les protéines, contrôlant ainsi l’expression des gènes. Cette découverte leur a valu l’obtention du Prix Nobel de médecine en 1965.
La même année, François Jacob, accompagné de deux autres chercheurs (Sydney Brenner et Matthew Meselson) fournit les preuves expérimentales de l’existence de l’ARNm. En utilisant le phage T4, un virus qui infecte les bactéries, ils ont montré que l’ARN nouvellement synthétisé dirige la production de protéines virales, confirmant ainsi le rôle de l’ARNm comme messager entre l’ADN et la machinerie de synthèse des protéines.
Enfin, toujours en 1961, Marshall Nirenberg et Heinrich Matthaei mènent des expériences qui ont contribué à la compréhension de l’ARNm. Ils ont montré que les ARN synthétiques pouvaient programmer la synthèse de protéines spécifiques dans un système acellulaire, mettant en lumière le lien direct entre la séquence d’ARNm et la production de protéines.
Ces découvertes ont jeté les bases de la biologie moléculaire moderne, ouvrant la voie à des innovations majeures dans le domaine de la génétique et de la biotechnologie.
Qu’est-ce que l’ARNm ?
L’ARN messager, ou ARNm, est une molécule essentielle dans le processus de synthèse des protéines au sein des cellules. Il agit comme un intermédiaire entre l’ADN, qui contient l’information génétique, et les ribosomes, qui sont les structures cellulaires responsables de la fabrication des protéines.
L’ARN messager (ARNm) est une molécule d’acide ribonucléique (ARN) qui joue un rôle central dans l’expression des gènes dans les cellules vivantes (transcription). C’est un intermédiaire essentiel dans le processus de synthèse des protéines, transférant l’information génétique codée dans le noyau cellulaire (ADN) vers les ribosomes dans le cytoplasme, où cette information est traduite en protéines fonctionnelles. Contrairement à l’ADN, qui est double brin, l’ARNm est une chaîne simple composée de nucléotides, incluant l’adénine (A), la cytosine (C), la guanine (G) et l’uracile (U).
On peut reprendre l’image proposée par l’Inserm qui illustre la définition suivante : « Le génome est représenté comme un livre, qui est passé par une photocopieuse. Il en sort une copie (l’ARN messager) qui part vers une usine, le Ribosome. De l’usine sort d’un côté une protéine (un rubik’s cube) et de l’autre de l’ARN messager dégradé (une feuille de papier en boule). »

Fonction de l’ARNm dans la synthèse des protéines
L’ARNm joue un rôle central dans la synthèse des protéines, un processus fondamental pour la vie. Ce processus se déroule en deux étapes principales : la transcription et la traduction.
La transcription est le processus par lequel l’information génétique contenue dans l’ADN est transcrite en une molécule d’ARNm. Cette première étape se déroule dans le noyau des cellules eucaryotes. L’ARN polymérase se lie à l’ADN au niveau d’un gène spécifique et synthétise une molécule d’ARNm en utilisant l’un des brins d’ADN comme matrice.
Durant la transcription, l’hélicase sépare les deux brins de l’ADN, permettant ainsi l’action de l’ARN polymérase. Pour commencer, celle-ci reconnaît et se fixe sur une région particulière de l’ADN du brin matrice, située en amont d’une région codante d’un gène : le site promoteur. Elle peut donc copier la séquence du brin codant qui y est complémentaire et antiparallèle jusqu’à atteindre le site terminateur qui permet au brin de se détacher.
(Source : Wikipédia)
Après sa synthèse, l’ARNm mature est exporté du noyau vers le cytoplasme, où il est « traduit » en protéine par les ribosomes, il s’agit de la traduction. Les ribosomes lisent la séquence de l’ARNm par groupes de trois nucléotides, appelés codons, chaque codon spécifiant un acide aminé particulier. Les acides aminés sont ensuite enchaînés pour former une protéine qui se replie pour acquérir une structure tridimensionnelle fonctionnelle.
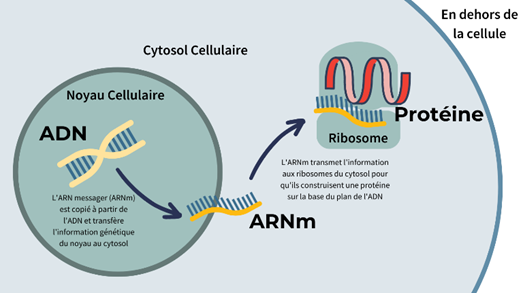
Vient ensuite la régulation : L’ARNm est rapidement dégradé après avoir été utilisé pour la synthèse protéique, ce qui permet de réguler la quantité de protéines produites dans la cellule. Contrairement à l’ADN, qui est stable et conservé tout au long de la vie de la cellule, l’ARNm est éphémère et ne persiste que quelques minutes à quelques heures dans le corps.
Ce processus, universel chez tous les êtres vivants, constitue le mécanisme par lequel l’information génétique est exprimée sous forme de phénotypes, c’est-à-dire de caractéristiques physiques et fonctionnelles des organismes.
L’ARNm et ses applications médicales
Les vaccins à ARNm
1. Principes et mécanismes
Les vaccins à ARNm représentent une approche innovante dans le domaine de l’immunisation, basée sur l’utilisation de l’information génétique plutôt que sur des formes atténuées ou inactivées du pathogène. Cette technologie repose sur l’insertion d’une molécule d’ARN messager synthétique dans l’organisme, codant pour une protéine spécifique du virus contre lequel on veut induire une réponse immunitaire.
a. Conception de l’ARNm : L’ARNm utilisé dans les vaccins est conçu pour coder une protéine spécifique du pathogène (comme la protéine spike pour le SARS-CoV-2), afin de déclencher une réponse immunitaire.
b. Administration : L’ARNm est encapsulé dans des nanoparticules lipidiques, qui agissent comme vecteurs pour protéger l’ARNm de la dégradation rapide et faciliter son entrée dans les cellules humaines après administration par injection intramusculaire.
c. Synthèse de la protéine virale : Une fois dans le cytoplasme des cellules, les ribosomes lisent l’ARNm et synthétisent la protéine virale correspondante. Cette protéine n’est pas nocive en elle-même, mais elle est reconnue comme étrangère par le système immunitaire.
d. Activation du système immunitaire : Les cellules immunitaires identifient la protéine virale et déclenchent une réponse immunitaire, incluant la production d’anticorps spécifiques et l’activation des cellules T. Si l’individu entre en contact avec le virus réel plus tard, son système immunitaire est prêt à répondre rapidement, neutralisant l’infection avant qu’elle ne cause des symptômes graves.
[Video Youtube Vaccin à ARNm : https://youtu.be/lzvmsC2k8uQ]
L’un des principaux avantages des vaccins à ARNm est leur rapidité de développement. Contrairement aux vaccins traditionnels, qui nécessitent la culture de virus en laboratoire et des procédés longs et coûteux, la technologie de l’ARNm permet de créer un vaccin en quelques semaines, une fois que la séquence génétique du virus est connue. De plus, ils ne contiennent ni virus vivant ni matériel pathogène, réduisant ainsi les risques liés à leur fabrication et à leur utilisation. Comme le signale le Dr Benoît Soubeyrand, consultant en vaccinologie « la personne vaccinée fabrique elle-même l’antigène, sans aucun risque de retour à des formes virulentes. La conformation de la protéine produite est parfaitement identique à la protéine virale. Ce qui n’est pas le cas avec d’autres types de vaccins utilisant des cellules d’insectes ou d’Escherichia coli pour fabriquer l’antigène ».
L’utilisation des vaccins ARNM dans le cadre de la Covid-19
La pandémie de Covid-19 a marqué un tournant décisif dans l’utilisation des vaccins à ARNm, avec le développement rapide de deux vaccins phares : Pfizer-BioNTech (BNT162b2) et Moderna (mRNA-1273). Ces deux vaccins ont démontré des niveaux d’efficacité inédits dans les essais cliniques (de l’ordre de 95%) et ont contribué de manière significative à la lutte contre la pandémie.
Les vaccins à ARNm ont été déterminants pour ralentir la propagation de la Covid-19 et réduire considérablement la mortalité liée à la pandémie. Leur flexibilité et la possibilité d’adapter rapidement les séquences d’ARNm à de nouveaux variants sont des avantages considérables. Par exemple, des versions mises à jour des vaccins à ARNm ont été développées pour lutter contre les variants Delta et Omicron.
Ces vaccins ont également démontré que la technologie de l’ARNm est non seulement viable, mais aussi extrêmement efficace pour répondre rapidement à une crise sanitaire mondiale, ce qui ouvre la voie à de futures applications de cette technologie pour d’autres maladies infectieuses, et même dans le traitement du cancer et d’autres pathologies.
Thérapies géniques à base d’ARNm
Les maladies génétiques sont causées par des mutations dans les gènes, entraînant soit la production de protéines dysfonctionnelles, soit l’absence totale de certaines protéines essentielles. Les thérapies à base d’ARNm offrent une stratégie pour pallier ces défaillances en fournissant directement les instructions nécessaires à la production des protéines manquantes ou correctrices.
Les thérapies géniques à base d’ARN messager (ARNm) représentent une innovation de pointe dans la médecine, visant à corriger ou traiter des maladies génétiques en modifiant directement l’expression des gènes défectueux. Cette approche utilise l’ARNm pour introduire des séquences d’ARN codant pour des protéines thérapeutiques ou correctrices dans les cellules affectées, contournant ainsi les mutations génétiques qui provoquent des pathologies. L’ARNm thérapeutique est conçu pour produire une version correcte de la protéine et est encapsulé dans des nanoparticules lipidiques pour le protéger et l’acheminer vers les cellules cibles. Une fois à l’intérieur, il est traduit en protéine fonctionnelle, permettant de restaurer une activité cellulaire normale et de corriger les effets de la mutation.
La thérapie génique consiste à introduire du matériel génétique dans des cellules pour soigner une maladie. Au départ, cette approche a été conçue pour suppléer un gène défectueux en cas de maladie monogénique (liée à la dysfonction d’un seul gène). Mais au cours des deux dernières décennies, l’évolution rapide des connaissances et des technologies a permis de démultiplier les stratégies possibles et d’élargir leur utilisation à de très nombreuses indications, dont certains cancers.
Source : Inserm
Les thérapies géniques à base d’ARNm en sont encore à leurs débuts, mais des avancées prometteuses ont déjà été réalisées dans plusieurs domaines de la médecine.
- Maladies génétiques rares : Certaines maladies monogéniques (celles causées par la mutation dans un seul gène) sont des candidates idéales pour les thérapies à ARNm. On peut notamment citer la dystrophie musculaire de Duchenne pour laquelle des recherches sont en cours afin d’utiliser l’ARNm pour restaurer la production de la dystrophine, une protéine essentielle dont l’absence conduit à une dégénérescence musculaire progressive. On peut également mentionner le déficit en ornithine transcarbamylase. Cette maladie génétique rare affecte le métabolisme de l’ammoniac dans le foie. Des essais cliniques explorent l’utilisation de l’ARNm pour produire une enzyme fonctionnelle chez les patients atteints de ce déficit.
- Maladies métaboliques : Les thérapies à base d’ARNm peuvent également viser des maladies métaboliques héréditaires, où une enzyme essentielle est absente ou non fonctionnelle. Le principe consiste à introduire un ARNm conçu pour coder une enzyme fonctionnelle dans les cellules du patient. Une fois traduit en protéine, cet ARNm permet à la cellule de produire l’enzyme nécessaire, rétablissant ainsi le fonctionnement normal du métabolisme. L’hypercholestérolémie familiale, le déficit en alpha-1-antitrypsine ou encore la maladie de Gaucher sont des pathologies génétiques visées par l’ARNm.
- Maladies respiratoires et fibrose kystique : dans le cas de maladies respiratoires comme la fibrose kystique (mucoviscidose), l’une des cibles prometteuses pour l’ARNm est la correction de la production défectueuse de la protéine CFTR (Cystic Fibrosis Transmembrane conductance Regulator). L’ARNm pourrait être utilisé pour restaurer une expression fonctionnelle de cette protéine dans les cellules pulmonaires, améliorant ainsi la qualité de vie des patients.
Oncologie et ARNm
L’utilisation de l’ARN messager dans le traitement du cancer représente une avancée prometteuse dans le domaine de l’immunothérapie. L’ARNm est utilisé pour stimuler le système immunitaire à cibler spécifiquement les cellules cancéreuses ou pour corriger des anomalies génétiques responsables de la croissance tumorale. Cette approche, encore en développement, offre de nouvelles perspectives dans la lutte contre les cancers résistants aux traitements traditionnels.
Les thérapies à base d’ARNm en oncologie reposent sur l’idée que l’ARNm peut être conçu pour exprimer des antigènes ou des protéines qui induisent une réponse immunitaire ciblée contre les cellules cancéreuses. Les applications les plus prometteuses incluent les vaccins thérapeutiques, les traitements d’immunomodulation (un immunomodulateur ou immunosuppresseur est un médicament qui bloque certaines fonctions du système de défense du corps humain et, par conséquent qui est administré pour réguler la réponse immunitaire du patient) et la thérapie génique ciblée.
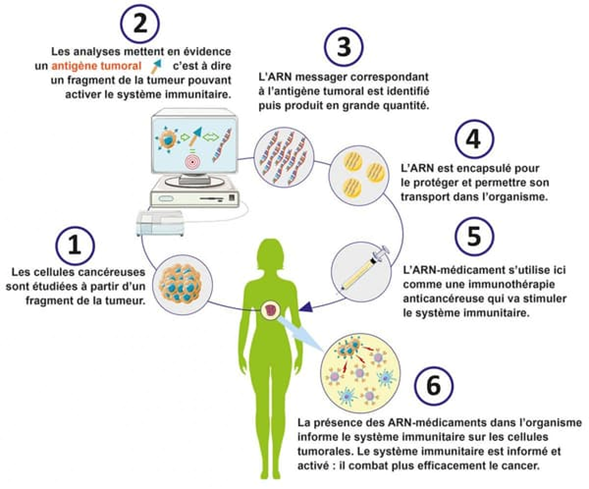
Parmi les voies de développement possibles, on retrouve les vaccins. Contrairement aux vaccins prophylactiques utilisés pour prévenir les maladies infectieuses, les vaccins à ARNm contre le cancer sont thérapeutiques, destinés à traiter un cancer existant en stimulant le système immunitaire à reconnaître et attaquer les cellules tumorales. Le principe est « simple » : l’ARNm est conçu pour coder des protéines ou des fragments de protéines spécifiques aux cellules cancéreuses, appelés néoantigènes. Ces néoantigènes sont dérivés de mutations présentes dans les cellules cancéreuses, ce qui les rend uniques aux patient et inoffensifs pour les cellules saines. Une fois injecté, l’ARNm est absorbé par les cellules dendritiques (cellules présentatrices d’antigène) et traduit en néoantigènes. Ces antigènes sont ensuite exposés à la surface des cellules, ce qui entraîne une activation des lymphocytes T et une attaque ciblée contre les cellules cancéreuses.
Récemment, BioNTech a annoncé le lancement de la phase d’essai d’un vaccin anticancer du poumon très prometteur. Le premier essai clinique de phase 1 pour le vaccin BNT116 a été lancé dans 34 centres de recherche répartis dans sept pays : Royaume-Uni, États-Unis, Allemagne, Hongrie, Pologne, Espagne et Turquie. Selon BioNTech, 130 patients participeront à cet essai. Les chercheurs espèrent que ce vaccin, en complément des traitements immunothérapeutiques existants, pourra améliorer de façon importante les taux de survie. Les prochaines étapes incluent les phases 2 et 3 des essais cliniques, avec l’objectif, à terme, de généraliser ce vaccin à l’échelle mondiale et sauver, au passage, des milliers de vies chaque année.
L’avenir des thérapies à base d’ARNm est prometteur, et les applications potentielles sont vastes. Les progrès rapides dans la recherche ouvrent de nouvelles perspectives pour traiter des maladies génétiques complexes ou des pathologies où les thérapies classiques sont limitées ou inefficaces. Voici quelques domaines clés où cette technologie pourrait transformer la médecine :
Régénération tissulaire : L’ARNm pourrait également être utilisé pour stimuler la production de protéines favorisant la régénération tissulaire après des blessures ou des maladies dégénératives.
Médecine personnalisée : À terme, il pourrait être possible de concevoir des traitements à ARNm sur mesure pour corriger les mutations spécifiques de chaque patient, ouvrant la voie à une médecine véritablement personnalisée.
Maladies neurodégénératives : Des recherches sont en cours pour utiliser l’ARNm afin de traiter des maladies comme la maladie de Parkinson ou Alzheimer en codant des protéines neuroprotectrices.
Pour continuer la lecture vers la 2ème partie de la note, cliquez sur l’image ci-dessous.
Lire la version courte de la note sur Les échos Judiciaires – Girondins







